内容概要:
酸和碱的首个化学描述
阿伦尼乌斯的定义首先解释了酸碱化学
布朗斯特-劳里的定义更全面解释了酸与碱
pH值:H+浓度的量度
酸碱中和
滴定:使用中和法测定溶液的pH值
运用酸碱化学,不一定非得是专业科学家。辣吃多了,胃部产生灼热感。可以用小苏打或药物冲服,为的就是引起化学反应——中和。
阿伦尼乌斯定义的酸:在水中溶解后会失去质子(H+)的物质;碱:在水中溶解后会失去OH-离子的物质。
布朗斯特-劳里定义的酸:贡献质子(H+)的物质;碱:接受质子的物质。
pH值测量溶液的酸度,它由氢离子的浓度决定。
pH值为7被认为是中性的,pH值低于7为酸性,高于7为碱性。
滴定是一种中和技术,可用于确定被中和物质的pH值。
如果曾经照顾过宠物鱼,你就会知道不能往鱼缸中添加普通自来水。这样做就是不顾及鱼生存所需环境的化学成分,鱼可能会因此而死。鱼的生存环境有一个重要的方面,那就是水的酸碱性。
图1:这个水族箱中的鱼,和它们在湖泊、河流、海洋中的亲戚一样,对周围水的pH值突然变化很敏感。向水族箱加水时,需要确保新水的pH值接近水箱中已有的水。
醋和柠檬汁等液体让人口水直流,这种酸味来自于它们的酸性。事实上,化学中的”酸“(acid)一词来自拉丁语acere,意思是“味道酸的”。酸的化学对立面是碱,这种化合物经常感觉像肥皂一样滑溜,核桃和西兰花等食物因为碱性而带苦味。虽然对酸和碱的定义各种各样,但为了讨论酸/碱化学的基本原理,我们将介绍两个定义:阿伦尼乌斯定义和布朗斯特-劳里定义。此外,我们还将介绍pH值以及中和酸和碱的过程,帮助让鱼保持健康。酸和碱的首个化学描述
几百年来,人们已经知道,柠檬和醋等物质具有acere(酸)的特征。十七世纪60年代中期,爱尔兰作家和业余化学家罗伯特·波义尔 (Robert Boyle) 根据以下特征首次将物质标记为酸或碱:酸:尝起来很酸,腐蚀金属,让石蕊(一种根据酸度改变颜色的染料)变红。
波义耳还观察到,酸的一些特性可以通过添加碱来抵消,反之亦然。他和其他人尝试解释,为什么酸和碱会这样。不过,对酸和碱的首个合理定义,还要再等200年后。在十九世纪00年代后期,瑞典科学家斯万特·阿伦尼乌斯 (Svante Arrhenius) 提出,水通过将许多化合物分离成单独的离子,从而溶解这些化合物。阿伦尼乌斯认为,酸是含有氢的化合物,可以溶于水并将氢离子释放到溶液中。例如,盐酸(HCl)溶于水如下: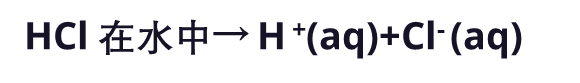
图2 斯万特·阿伦尼乌斯在实验室中
阿伦尼乌斯对碱的定义是,溶解于水会释放氧化氢离子(OH- )。例如,氢氧化钠就是阿伦尼乌斯所定义的碱的典型例子。

阿伦尼乌斯对酸和碱的定义解释了许多事情。阿伦尼乌斯的定义解释了为什么所有酸都具有相似的性质,为什么所有碱都是相似的。酸都释放H+到溶液中,而碱都释放OH- 。阿伦尼乌斯的定义也解释了波义耳的观察,即酸和碱相互抵消。当与酸混合时,碱性溶液变得没那么碱性,反之亦然,这种想法被称为中和 - 我们将进一步讨论这个概念。尽管阿伦尼乌斯帮助解释了酸/碱化学的基本原理,但他的想法有局限。例如,阿伦尼乌斯的定义没有解释为什么某些物质,如普通小苏打(NaHCO3),可以中和酸(因此像碱一样),即使它们不含氢氧根离子。【考考自己】阿伦尼乌斯认为碱在水中溶解时会释放______1923年,丹麦科学家约翰内斯·布伦斯特德(Johannes Brønsted)和英国人托马斯·劳里(Thomas Lowry)独立发表了类似的论文,完善了阿伦尼乌斯的理论。用布伦斯特德的话来说,“......酸和碱是能够分别分解或吸收氢离子的物质。布伦斯特德-劳里的定义,拓宽了阿伦尼乌斯的酸碱概念。对酸的定义,布伦斯特德-劳里与阿伦尼乌斯一样,是任何可以向溶液提供氢离子的物质(根据布伦斯特德的定义,酸通常被称为质子供体,因为H+离子 - 氢减去其电子 - 仅由一个质子组成)。然而对碱基的定义,布伦斯特德与阿伦尼乌斯大不相同。布伦斯特德将碱定义为任何可以接受氢离子的物质。从本质上讲,碱与酸相反。正如我们上面看到的,NaOH仍将被视为碱,因为一旦溶解在水中,OH-可以接受酸中的H+形成水。布伦斯特德-劳里的定义也解释了,为什么不含OH-的物质也可以像碱一样起作用。抗酸药片就是一个很好的例子。如果你看一下抗酸剂包装上的成分,你可能会看到其中就有碳酸钙(CaCO3)。为什么这种化合物可以作为抗酸剂?我们需要花点时间考虑一下比萨饼(如果它上面有番茄酱,则酸性相当强)。图3:含有碳酸钙的抗酸片释放碳酸根离子。这些离子充当碱来吸收比萨饼和胃中发现的酸性氢离子。
当你吃食物(甚至开始考虑吃东西)时,你的胃会产生盐酸(HCl),这是一种强酸,它可以分解食物以帮助消化。在胃中的酸-水混合物中,HCl解离,这意味着它分成了离子,这里氢离子和氯离子:
这些H+使胃中的溶液呈酸性。太多了就会消化不良。所以,你服用一种抗酸剂,它解离成钙和碳酸根离子:
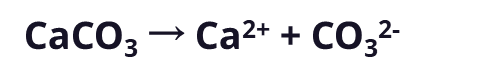
这些CO32-离子实际上就是碱,它能吸在胃里游荡H+。啊,还好有它!
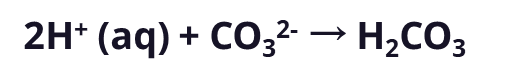
这个例子中,碳酸钙经历了快速分解,形成水与气态的二氧化碳
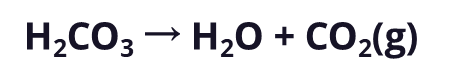
虽然这种反应会降低胃中的酸度,但产生的气态二氧化碳会积聚在胃中,最终让你打嗝。所以,总而言之,最好避免暴饮暴食披萨之类的食物。根据阿伦尼乌斯和布伦斯特德-劳里的定义,酸和碱都与存在的氢离子浓度有关。酸增加氢离子的浓度,而碱降低氢离子的浓度(通过接受它们)。因此,某物的酸度或碱度可以通过其氢离子浓度来测量。
【考考自己】布伦斯特德定义碱是_____的物质。
a.释放氢离子
pH值:H+浓度的量度
1909年,丹麦生物化学家索伦森(Sören Sörensen)发明了用于测量酸度的pH值标度。索伦森正在研究酶(催化生物化学反应的蛋白质)的活性,并注意到溶液的酸度会影响酶催化反应的能力。当时,没有很好的方法来阐明一种化合物与另一种化合物的酸性比较。对缺乏测量系统感到沮丧的索伦森,发明了pH值标度。虽然“pH”的确切含义仍有争议,但有些人认为它代表“氢的力量(power of hydrogen)”。
拓展阅读:酸碱测试——pH试纸的发明
无论字母代表什么,pH值都是一种测量溶液中可用于参与反应的H+离子浓度的方法。(要查看浓度,请参阅我们的溶液、溶解度和聚合性质模块中关于摩尔浓度的部分。pH标度是对数标度,这意味着刻度上每增加1,例如从pH值2到pH值3,氢离子的浓度减少10倍。pH值为2时有1x10-2 mol H+/L,pH值为3时具有1x10-3mol H+/L。
请注意,浓度的指数是负数。因此,从数学上讲,pH值实际上是溶液中 H+浓度的倒数:
pH = -log [H+]
注意:浓度通常使用方括号缩写,因此[H+]=氢离子浓度。测量 pH值时,[H+]以每升溶液中H+摩尔数为单位。不要被数学吓到!即使不熟悉对数,仍然很容易理解。可以将对数视为[H+]中10的指数。例如,[H+]=1x10-7mol/L的溶液的pH值等于7。pH 值为正值,因为我们取负数 -(-7),负负得正。比如室温下的水,纯水的pH值为7,这意味着[H+](氢离子的浓度)为1x10-7,即0.0000001。pH值为7被认为是中性的,这意味着[H+]和 [OH-] 相等。1x10-7或0.0000001 mol/L 的浓度可能看起来很小,但中性两侧浓度的变化会对化学产生很大的影响。当[H+]大于10-7 (例如,如果它等于1x10-6)时,解是基本的。如果[H+]小于10-7 (例如,如果它等于 1x10-8),则溶液呈酸性。如果指数和浓度令人困惑,可以这样想:请记住,当我们处理负指数时,我们谈论的是小数点和1之间放置的零的个数。零越多,数字越小,解中的 H+就越少。例如:0.0000001(1x10-7)比0.00000001(1x10-8)大十倍。由于pH值是[H+] 的量度,因此1x10-8表示[H+]比1x10-7小十倍。现在,比较这两个数字的指数:-7和-8。如果我们去掉负号,我们就有了 pH值。1x10-7的pH值为7,1x10-8的pH值为8。因此,与预期相反,较高的pH值代表较小的 [H+]。氢离子的存在是导致酸度的原因,相反,缺乏H+(或 OH-的存在)是导致碱度的原因。因此,随着[H+]变小(pH 值变高),溶液的酸性降低,碱性更强。由于7是中性pH值,因此pH值大于7的溶液是碱性的,因为它的 [H+]小于1x10-7。同样,pH值小于7的溶液是酸性的,并且[H+]大于1x10-7。
例如:
1x10-3的[H+],pH值为3,溶液呈酸性。
1x10-11的[H+],pH值为11,溶液呈碱性。pH值范围为0到14。pH值为0至7的物质被认为是酸性的。pH值7到14的物质被认为是碱性的。pH=7是中性物质,例如纯水。[H+]和pH值之间的关系如下表所示,以及日常生活中酸和碱的一些常见示例。| | [H+] | pH值
| 举例
|
|---|
| 酸 | 1 X 100 | 0 | HCl |
| 1 x 10-1 | 1 | 胃酸 |
| 1 x 10-2 | 2 | 柠檬汁 |
| 1 x 10-3 | 3 | 果醋 |
| 1 x 10-4 | 4 | 苏打 |
| 1 x 10-5 | 5 | 雨水 |
| 1 x 10-6 | 6 | 牛奶 |
| 中性 | 1 x 10-7 | 7 | 纯水 |
| 碱 | 1 x 10-8 | 8 | 蛋白 |
| 1 x 10-9 | 9 | 小苏打 |
| 1 x 10-10 | 10 | 抗胃酸药物 |
| 1 x 10-11 | 11 | 氨水 |
| 1 x 10-12 | 12 | 消石灰 |
| 1 x 10-13 | 13 | 管道疏通剂 |
| 1 x 10-14 | 14 | NaOH |
b.高
酸碱中和
回到我们之前贪吃披萨的例子。pH表显示带有HCl的胃酸pH值为1,非常酸。正是胃中的酸量让你感觉到“胃灼热”中的“灼热”。请记住,抗胃酸药物含有碱碳酸钙(CaCO3),其pH值为10。当我们将CaCO3碱基添加到 HCl混合物中时,产生的CO32-离子能够吸收H+,使混合物更接近 7 的中性pH值。这是一种中和反应,其中将碱添加到酸中以提高pH值(反之亦然)。实验室里,也可以进行中和反应。例如,我们可以将 NaOH 添加到 HCl 的图片中以中和酸。在这种情况下,中和反应涉及来自酸的H+和来自碱的 OH- 。(这是应用阿伦尼乌斯定义的一个例子)。两种离子结合形成水分子,将酸性和碱性离子从溶液中取出。
HCl + H2O → H+(aq) + Cl-+(aq)
NaOH + H2O → Na+(aq) + OH-+(aq)
从方程式中可以看出,酸性HCl将H+释放到溶液中,NaOH碱释放OH- 。如果我们将酸和碱混合在一起,H+离子与OH-离子结合生成水,H2O:当酸中的每个H+与OH-配对并中和时,溶液的pH值将为7。滴定:使用中和法测定溶液的pH值
中和也可用于测定溶液的pH值。例如,假设你需要中和采矿作业中的酸性径流,你正在查看的采矿过程会产生HCl,但你不知道径流中HCl的浓度,就可以通过用已知浓度的碱溶液中和径流样品,跟踪用了多少碱溶液,从而确定HCl浓度。由此,你可以计算径流中的HCl浓度。通过用已知浓度的溶液中和未知浓度的溶液来测定pH值的过程,称为滴定法。在实验室中,滴定涉及使用特定设备进行设置,以保持过程的准确性,因为你需要知道酸的起始体积和使用的碱量。图 4:用 NaOH 滴定 HCl 的设置。
如图4所示,20mL含有HCl的径流溶液并置于烧瓶中。滴定管(本质上是一个底部带有旋塞阀的量筒,允许测量所添加的碱)填充NaOH,固定以便于向酸中添加少量碱。(如果需要查看摩尔浓度,请参阅“溶液、溶解度和低密度特性”模块)。HCl溶液还含有少量称为pH指示剂的分子。指示剂是一种物质,当溶解在水中时,在特定的pH值下会改变颜色,表明烧瓶中的溶液已达到该pH值。在这种情况下,将使用在pH值为7时变色的指示剂,因为你想知道酸溶液何时被完全中和。要进行滴定,需要注意NaOH的起始体积。假设是500毫升。慢慢添加碱,直到烧瓶中的溶液变色,然后停止。然后注意添加到酸中的碱的体积,假设它是460毫升。起始500mL – 结束460mL=40mL NaOH添加到烧瓶中的酸中。因为我们知道 NaOH 的浓度,所以我们可以确定 40 mL 中有多少摩尔求x: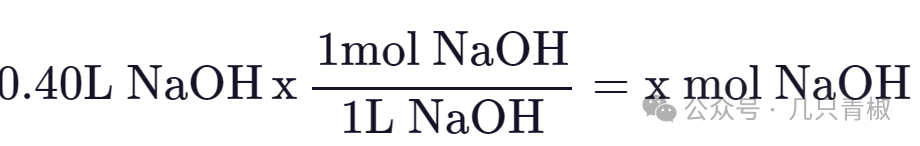 我们知道,NaOH在水中会释放一个OH-,而HCl会释放一个H+。就是说,每molHC了就需要1mol的NaOH去中和。既然我们滴定用了0.4mol的NaOH,那么我们烧杯里的HCl就是0.40mol。我们用摩尔数除以体积,得到HCl的浓度:0.4mol/0.2L=2mol/L
我们知道,NaOH在水中会释放一个OH-,而HCl会释放一个H+。就是说,每molHC了就需要1mol的NaOH去中和。既然我们滴定用了0.4mol的NaOH,那么我们烧杯里的HCl就是0.40mol。我们用摩尔数除以体积,得到HCl的浓度:0.4mol/0.2L=2mol/L